А.Г. Меденцев, А.Н. Котик, В.А. Труфанова, В.К. Акименко
Институт биохимии и физиологии микроорганизмов РАН, Пущино
Институт птицеводства УААН
Из пораженного зерна выделены 20 изолятов грибов, относящихся к Fusarium graminearum. Скармливание биомассы большинства изолятов курам-нссушкам вызывало синдром ухудшения качества яйца. Установлено, что все эти изоляты образовывали окрашенный желто-оранжепый метаболит, обладающий антибиотической активностью против мицелиальных грибов и дрожжей. С помощью физико-химических исследований метаболит идентифицирован как димерный нафтохинон аурофузарин. Образование изолятами других микотоксинов - зеаралснона и дезоксиниваленола — не было сопряжено с появлением указанного синдрома.
Грибы Fusarium graminearum (совершенная стадия Gibberella zeae) поражают широкий круг зерновых культур, включая пшеницу, кукурузу, ячмень и другие. В результате заражения оболочка зерна приобретает розовое окрашивание, а в зерне могут накапливаться микотоксины, в частности зеараленон [1] и трихотеценовые микотоксины типа В [2]. В ряде случаев обнаружена способность F. graminearum образовывать окрашенные метаболиты нафтохиноновой структуры [3, 4].
Ранее [5] было обнаружено, что у кур-несушек, которым скармливали пораженное грибами зерно или убитую культуру грибов, наблюдался не известный прежде синдром ухудшения качества яйца. Характерным признаком указанного синдрома является неспецифический коричневый оттенок желтка. Кроме того, изменялись некоторые морфологические признаки яйца и снижались оплодотворенность и выводимость [5].
В работе представлены данные по выявлению и идентификации у грибов фактора, ответственного за появление признаков синдрома ухудшении качества яйца.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методика
Изоляты грибов Fusarium graminearum были выделены из кукурузного и пшеничного зерна, выращенного в период 1985 - 1988 гг в Винницкой и Харьковской областях.
Культивирование грибов осуществляли на стерильной, увлажненной зерновой смеси просо : рис (1:1) при 28° в течение 1 нед., затем 2 нед. при 10° и 4 нед. при 28°. Биомассу собирали, инактивировали при 110°, сушили при комнатной температуре и хранили при 10°.
Способность грибов вызывать синдром ухудшения качества яйца определили путем включения инактивированной биомассы и рацион кур-несушек в количестве 5% от состава зерна. Наблюдение за клиническим состоянием кур и учет качества яйца вели в течение последующих 4 нед.
Для выделения и идентификации пигментов грибы культивировали на среде Чапека [7]. Пигмент экстрагировали хлороформом из высушенного мицелия. Экстракт фильтровали через стеклянный фильтр, подсушивали безводным сульфатом натрия и концентрировали в вакууме. Пигмент очищали с помощью препаративной хроматографии на пластинках (20х20 см) с 1 мм спликагели Si-60 «Merck» (Германия) в системе хлороформ : метанол : уксусная кислота (96:2:2). Кристаллизовали пигмент из хлороформа путем добавления этилацетата. Спектры поглощения пигмента в УФ-видимой области регистрировали на спектрофотометре UV-160 «Shimadzu» (Япония).
Масс-спектры снимали на масс-спектрометре «Finnigan» MAT-8430 (США). ИК-спектры регистрировали на спектрофотометре FTTR-1710 «Perkin Elmer» (США) в таблетках КВг. Спектры Н-ЯМР снимали в CDCh на спектрометре WPTO S-9 «Brucner» (ФРГ) с тетраметилсиланом (ТМС) в качестве внутреннего стандарта. Содержание в экстрактах культур зеараленона и деоксиниваленола определяли с помощью тонкослойной, хроматографии. В качестве свидетелей использовали стандарты микотоксииов фирмы «Sigma» (США).
Антибиотическую активность метаболитов исследовали биоавтографическим методом [6]. Микроорганизмы, используемые для определения антибиотической активности, были получены из Всесоюзной коллекции микроорганизмов (ВКМ).
Результаты и их обсуждение
При исследовании микробного состава пораженного зерна были получены 20 изолятов грибов Fmarium graminearum. Оказалось, что большинство из них при скармливании курам-несушкам вызывали признаки синдрома ухудшения качества яйца. Желток приобретал нехарактерный коричневый цвет и глубокую пятнистость, на поверхности образовывался белый налет, увеличивалась высота желтка и белка, набухали муциновые волокна градинок. При этом происходило снижение оплодотворенности и выводимости яиц [5].
Для выявления фактора, ответственного за синдром ухудшения качества яйца, был изучен состав метаболитов, образуемых изолятами грибов.
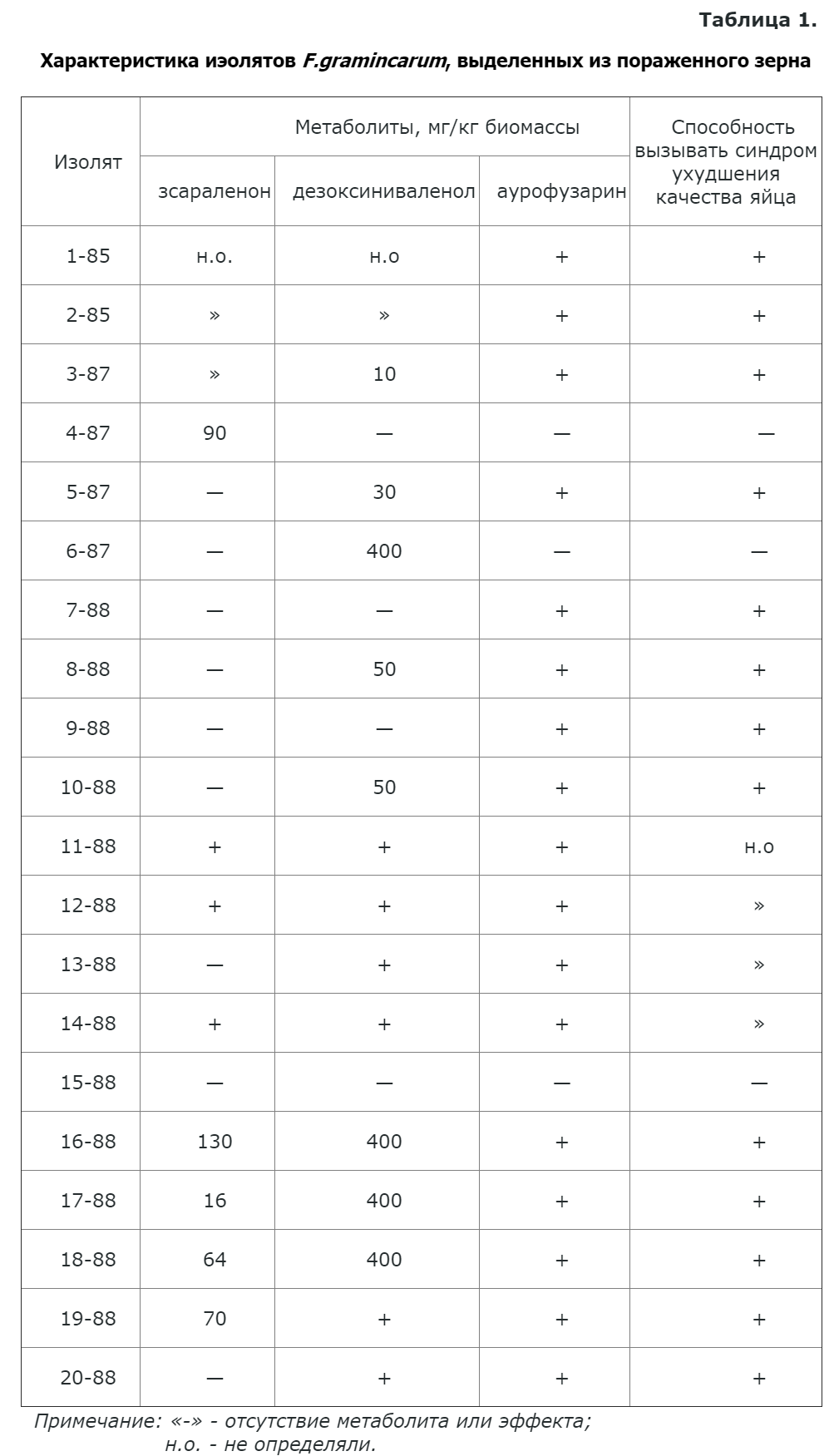
Из данных табл. 1 следует, что 14 культур образовывали дезоксиниваленол в количестве от 10 до 400 мг/кг биомассы. В 8 изолятах обнаруживался зеараленон (от 16 до 130 мг/кг мицелия). Из результатов таблицы следует также, что синдром ухудшения качества яйца не был связан с наличием в грибах дезоксиниваленола или зеараленона. Так, изолиты 4—87 и 6—87, образующие по отдельности зеараленон или дезоксиниваленол и сравнительно высоком количестве, не вызывали появления признаков указанного синдрома. Эти результаты находятся в соответствии с данными Тренхольма и соавт. [8], полученными в результате полевых наблюдений.
Дальнейшие исследования с помощью биоавтографии показали, что ряд изолятов содержит антибиотическое вещество с высокой активностью против дрожжей рода Torulopsis и Candida (табл. 1, 2).
Необходимо отметить, что антибиотические свойства метаболита проявляются практически только на эукариотных организмах, тогда как бактериальные оставались нечувствительными (табл. 2). Оказалось, что появление признаков указанного синдрома полностью сопряжено с наличием в биомассе изолятов этого соединения (табл. 1).
Необходимо также отметить, что зависимость появления синдрома ухудшения качества яйца от наличия обнаруженного нами соединения свидетельствует тот факт, что мутанты F. graminearum утратившие способность к образованию метаболита, не вызывали этого синдрома.
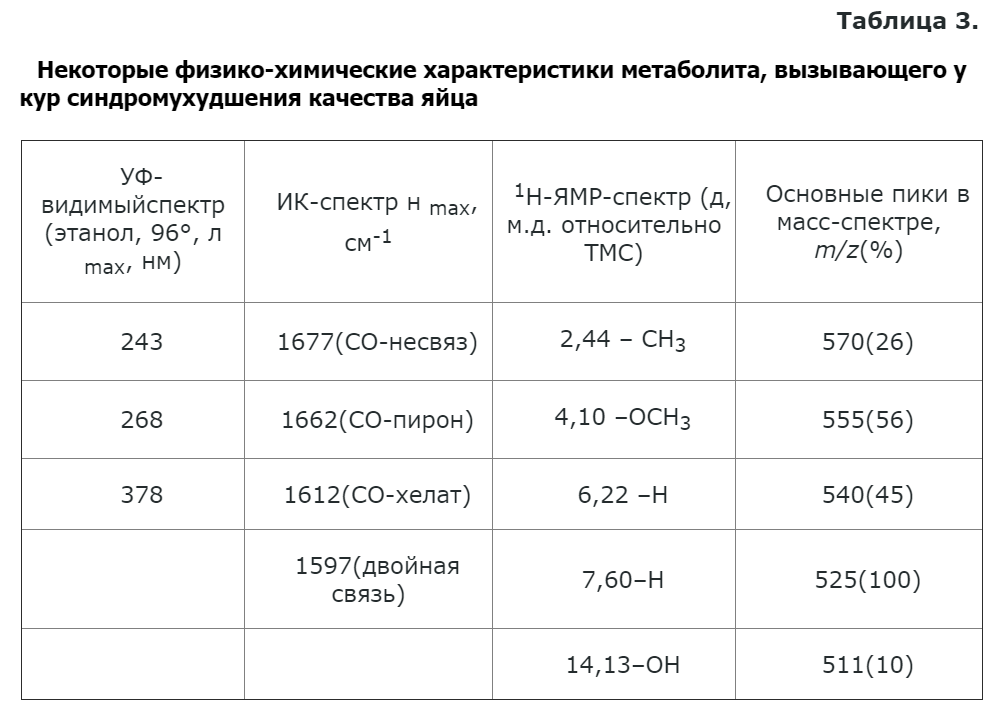
Для идентификации метаболит был выделен в кристаллическом состоянии и исследован с помощью физико-химических методов. Данные спектроскопических исследований метаболита представлены в табл. 3.
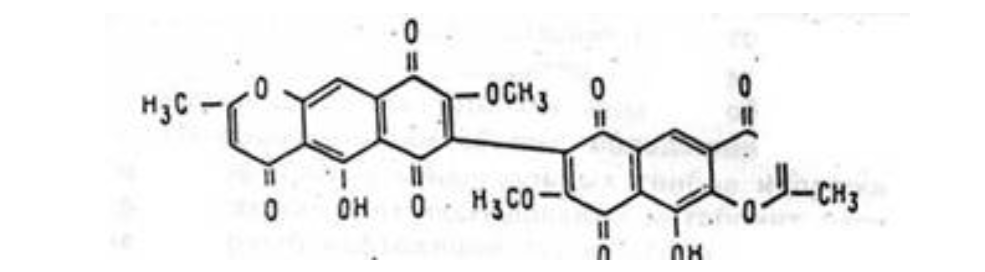
Сравнительный анализ наших результатов (табл. 3) и литературных данных [3, 4] показал, что максимумы поглощения этого соединения в УФ-видимой области спектра, а также ИК- и 'Н-ЯМР-спектры идентичны с таковыми, полученными для димериого нафтохинона аурофузарина. Этот факт, а также наличие в масс-спектре молекулярного иона с m/z 570 (табл. 3) позволили нам однозначно идентифицировать метаболит как аурофузарин (рисунок).
Структурная формула аурофузарина — метаболита грибов Аурофузарин способен в зависимости от рН заметно изменять окраску от желто-оранжевой при низких рН до фиолетовой при щелочных значениях. Можно предположить, что именно это его свойство проявляется в первую очередь при изменении окраски желтка яйца, являющегося одним из основных признаков ухудшения его качества. Механизм отрицательного эффекта аурофузарина па оплодотворенность и выводимость требует дополнительных исследований.
Авторы признательны сотрудникам института Б.П. Баскунову и В.Г. Сахаровскому за снятие спектров аурофузарина.
Список литературы
Stob М.. Baldwin S.R.. Tuit J., Andrews F.N. // Nature. 1962. V.196. № 4861. - P. 1318.
Ichinoe M.t Kurata H. // Trichothecenes, Chemical. Biological and Toxicological Aspects. Elsevier, 1983. P. 73—82.
Ashley J.N.. Hobbs B.C.. Raistrick H. // Biochem. J. 1937. V. 31. N 2. P. 73—82.
Shibata S., Morishita E., Takeda Т., Sakata K. // Chem. Pharm. Bull. 1968. V. 16. № 3. P. 405—410.
Котик А.Н., Труфанова В.А. // Науч.-техи. бюл. УНИИП. Харьков, 1990. N° 29. С. 41-42.
Котик А.Н., Труфанова В.А. II Гигиена и санитария. 1989.№ 9. С. 53—54.
Меденцев А.Г., Пискунов Б.П., Акименко В.К. // Биохимия. 1989. Т. 54. № 4. С. 619-628.
Trenholm H.L. Prelusky D.B., Young J.C., Miller J.D. // Arch. Environ. Contam. Toxicol. 1989. V. 18. № 3. p. 443—451.
Источник: avianua.com